|
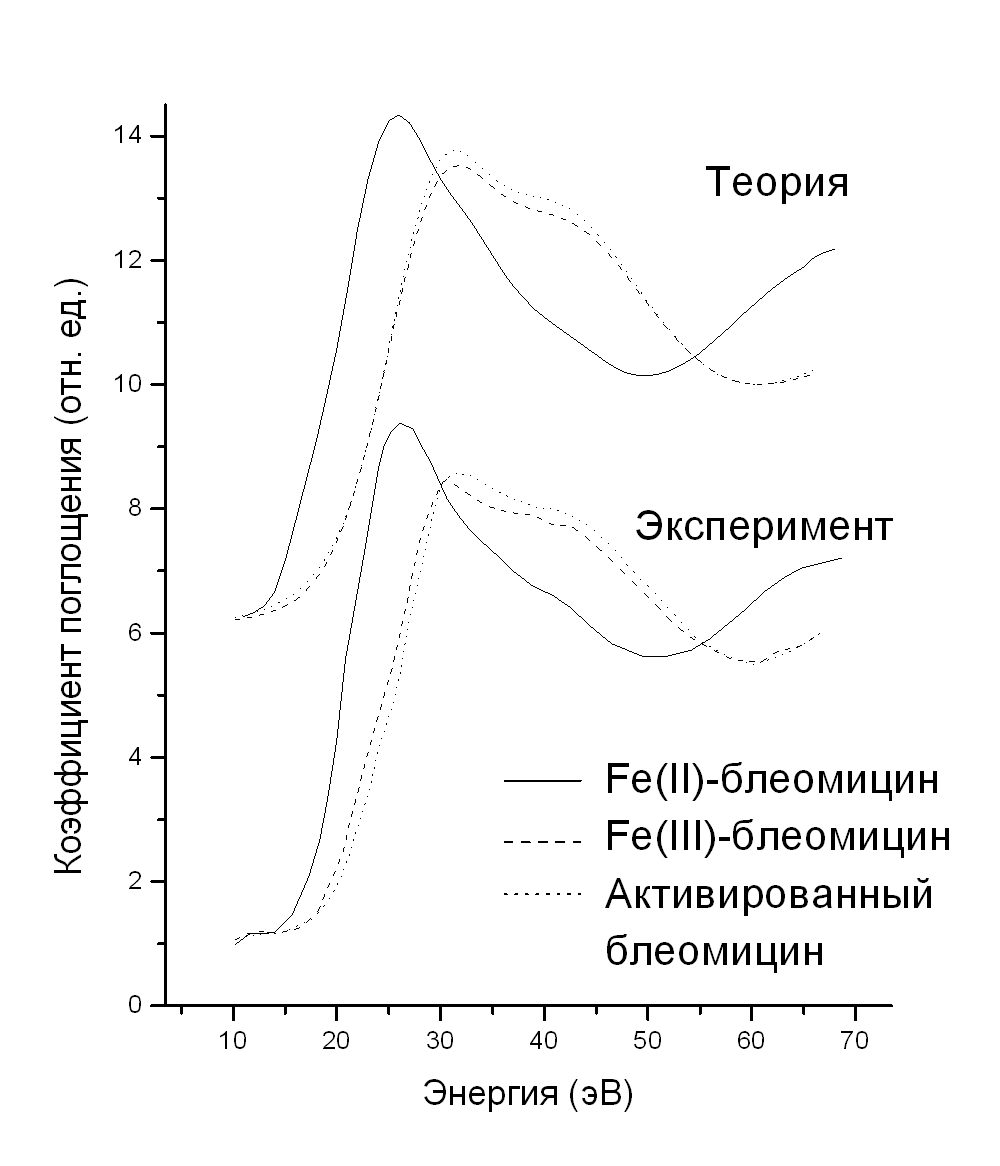
Применение рентгеновской спектроскопии поглощения для исследования электронной и локальной структуры блеомицина Ростовский государственный университет Научный руководитель: Солдатов Александр Владимирович, Доктор физико-математических наук Выяснение механизма взаимодействия блеомицина с ДНК является необходимым для понимания его свойств как антибиотика. В свою очередь для этого важно знать с высоким разрешением локальную и электронную структуры той формы комплекса, которая непосредственно взаимодействует с ДНК - активированного блеомицина. Стабильной формой этого антибиотика является комплекс с Fe(II) ионом. Его локальная структура была нами исследована отдельно. Задачей данной работы являлось выяснение чувствительности K-XANES спектров поглощения железа к изменениям локальной и электронной структуры и определение на основе полученных результатов геометрии и электронной структуры активированного блеомицина. Согласно имеющейся в литературе модели формирования активированного блеомицина сначала один из лигандов железа -азот Для разделения влияния на спектр поглощения изменений в локальной и электронной структурах были произведены расчеты K-XANES спектров железа для Fe(II), Fe(III) и активированного блеомицина вначале только с изменением в электронной конфигурации, а затем - только в геометрической структуре. Расчеты проводились методом многократного рассеяния в большом кластере в сочетании со спин-поляризованным расчетом потенциала по методу самосогласованного поля рассеяных волн с локальным потенциалом в Сравнение предкраевых областей экспериментальных спектров для Fe(III)- и активированного блеомицина позволяет утверждать, что оба комплекса имеют сходную электронную структуру, то есть активированный блеомицин является Fe(III) низкоспиновым комплексом. Путем варьирования среднего расстояния Fe-N и Fe-O для первой координационной сферы металла и сравнения сдвига края поглощения и положений пиков за краем было получено, что среднее расстояние между Fe и N составляет 1.89 ангстрем для Fe(III)-Bl и 1.91 ангстрем для активированного блеомицина, а длина связи Fe-O возрастает с 1.87 ангстрем до 1.97 ангстрем при переходе Fe(III)-Bl -> активированный блеомицин. На (рис.1) приведены рассчитанные и экспериментальные спектры поглощения Fe для всех трех комплексов антибиотика.
рис.1 |
| (c) АСФ России, 2001 |