|
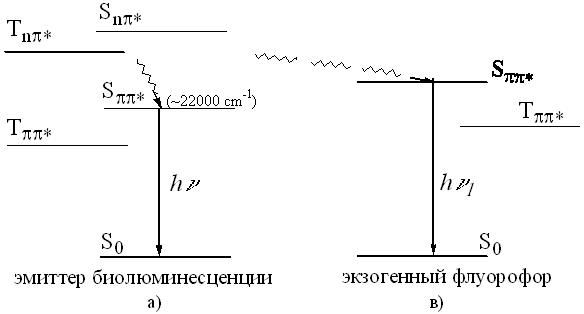
Высшие электронно-возбужденные состояния в бактериальной биолюминесценции: спектроскопические исследования Институт биофизики СО РАН Научный руководитель: Кудряшева Надежда Степановна, к. ф.-м. н. В основе биолюминесценции бактерий лежит ферментативная реакция окисления восстановленного флавинмононуклеотида и длинноцепочечного альдегида кислородом воздуха с участием специального фермента - люциферазы. Считается, что квант света ( » 490 нм) в такой реакции излучается возбужденным флавин-люциферазным комплексом. Эмиттер бактериальной биолюминесценции (4А-гидроксифлавин) как гетероциклическое соединение с высоким выходом флуоресценции характеризуется ненизшими триплетными состояниями np *-типа (см. рис. 1а). Детали физико-химических процессов, ведущих к образованию электронно-возбужденного эмиттера бактериальной биолюминесценции, до сих пор неясны. Согласно одной из гипотез, в результате химических преобразований сначала образуется 4а-гидроксифлавин в более высоковозбужденном, чем флуоресцентное Sp p *, состоянии. Затем происходит перенос энергии возбуждения на “вторичный” эмиттер, который и излучает квант света (рис. 1а). При этом перенос энергии может осуществляться как внутримолекулярно (на низлежашие уровни 4А-гидроксифлавина, тогда излучается квант hn , рис.1а), так и по межмолекулярному пути (на присутствующий в окружении флуорофор с подходящими спектральными свойствами, тогда излучается квант hn 1, рис.1в).
рис. 1 В данной работе возбужденные состояния эмиттера бактериальной биолюминесценции изучались с помощью флуоресцентных соединений с разными люминесцентными характеристиками. Соединения были подобраны таким образом, чтобы их спектры поглощения не перекрывались со спектром биолюминесценции, а Sp p *-уровни их молекул имели энергию, большую, чем флуоресцентный уровень 4А-гидроксифлавина (~22000 см-1). Были измерены спектры бактериальной биолюминесценции in vitro в присутствии молекул с энергией флуоресцентного состояния, лежащей в диапазоне 25000-32000 см-1 (антрацен, РОРОР, МСБ, пирен, метоксинафталин, пара-терфенил). Была зарегистрирована сенсибилизированная люминесценция первых трех соединений в виде слабоинтенсивных пиков в коротковолновой области спектра биолюминесценции. Так как спектры поглощения этих соединений не перекрываются со спектром биолюминесценции, полученные данные были объяснены безызлучательным межмолекулярным переносом энергии, при котором донором являются высшие электронно-возбужденные состояния эмиттера биолюминесценции, а акцептором – флуоресцентные состояния молекул красителей (рис.1). По полученным результатам было сделано предположение, что гипотетический уровень-предшественник флуоресцентного состояния эмиттера биолюминесценции имеет энергию приблизительно 26000 см-1, т.к. для соединений с более высокими Sp p * -уровнями (пирен, метоксинафталин, терфенил) сенсибилизированную люминесценцию в биолюминесцентной системе зафиксировать не удалось. Таким образом, полученные результаты подтвердили гипотезу об активности ненизших возбужденных состояний биолюминесцентного эмиттера.Дополнительно, было изучено взаимодействие антрацена, РОРОР и МСБ с бактериальной люциферазой методами флуоресцентной спектроскопии с временным разрешением. Был записан спад анизотропии флуоресценции данных гидрофобных соединений в средах разной полярности (спиртовой и водно-спиртовой) и в присутствии бактериальной люциферазы. Динамика спада анизотропии была описана как сумма экспонент. Получено, что времена вращательной корреляции, характерные для водно-спиртовых растворов соединений в присутствии люциферазы, далеки от времен, характерных для самого фермента (4-12 нс и 33-39 нс соответственно). Это означает отсутствие жестких (ковалентных) связей между исследованными молекулами и ферментом. С другой стороны, было найдено, что присутствие фермента меняет параметры спада анизотропии веществ: времена вращательной корреляции в присутствии люциферазы не совпадают с временами, характерными для спиртовых и водно-спиртовых растворов соединений. Полученные результаты были объяснены возможным гидрофобным взаимодействием между люциферазой и исследованными молекулами. РОРОР, МСБ относятся к слабо полярным соединениям, а молекула антрацена – неполярна, поэтому возможно, что в водно-спиртовых средах люцифераза адсорбирует данные молекулы. Главную роль в межмолекулярном взаимодействии фермента и ароматической молекулы в нашем случае играют, видимо, дисперсионные (или Лондоновские) силы притяжения. Эти силы действуют на расстояниях <1 нм. Такое сближение люциферазы и ароматической молекулы подтверждает возможность осуществления переноса энергии по обменно-резонансному (столкновительному) механизму с эмиттера биолюминесценции на присутствующую молекулу.Таким образом, по полученным результатам сделаны следующие выводы:
|
| (c) АСФ России, 2001 |