|
Термодинамика нуклеации на растворимых ядрах из сильных электролитов Санкт-Петербургский государственный университет Научный руководитель: Щекин Александр Кимович, д.ф.-м.н. Ядра конденсации из сильных электролитов, таких как KCl, NaCl и другие, являются щироко распространёнными в условиях атмосферы Земли. Известно, что благодаря высокой растворимости в конденсирующейся из окружающей паро-газовой среды воде (в дальнейшем будем называть конденсирующуюся в капли жидкость конденсатом), эти ядра конденсации являются наиболее активными, то есть способными вызывать интенсивное фазовое превращение в пересыщенных парах даже при очень низких пересыщениях пара. В термодинамике нуклеации на растворимых ядрах из сильных электролитов, основы которой были заложены Кёлером [1], обычно пренебрегается адсорбцией ионов растворившегося вещества ядра в поверхностном слое зарождающихся капель. Однако ответа на вопрос, когда это пренебрежение оправдано и когда надо учитывать адсорбцию ионов, на сегодняшний день в литературе нет. Кроме того, именно при учете адсорбции ионов растворимого ядра вблизи поверхности капли возможно различать электролиты, формирующие ядро конденсации, по их влиянию на нуклеационный процесс (в рамках теории Кёлера они неразличимы). Учёту адсорбции ионов ядра конденсации из сильного электролита в поверхностном слое зарождающихся капель в термодинамике гетерогенной нуклеации и будет посвящено данное сообщение.Поверхностное натяжение и адсорбция . Теория поверхностного натяжения растворов сильных электролитов была развита Онзагером и Самарасом в [2]. В сокращенном виде эта теория изложена в [3].Согласно [3] для поверхностного натяжения
Здесь Вместо величин s и G удобнее пользоваться безразмерными поверхностным натяжением , ,
где Химический потенциал конденсата в капле и его экстремум . Рассмотрим теперь каплю, содержащую
где первое слагаемое в правой части связано с осмотическим давлением в растворе, а второе слагаемое – с капиллярным давлением под сферической поверхностью капли. В [4] было показано, что важную роль в термодинамике нуклеации
на растворимых ядрах играют экстремумы химического потенциала конденсата в капле
как функции размера капли. В частности, максимум Исследуя экстремумы (5) с учетом (3) и (4), можно показать, что
условие
Соотношение (6) представляет собой главный результат, так как определяет поправки к пороговому значению химического потенциала пара, обусловленные учетом адсорбции ионов в поверхностном слое капель. |
| (c) АСФ России, 2001 |
 , (1)
, (1) . (2)
. (2)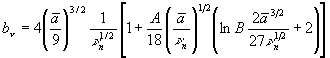 . (6)
. (6)