|
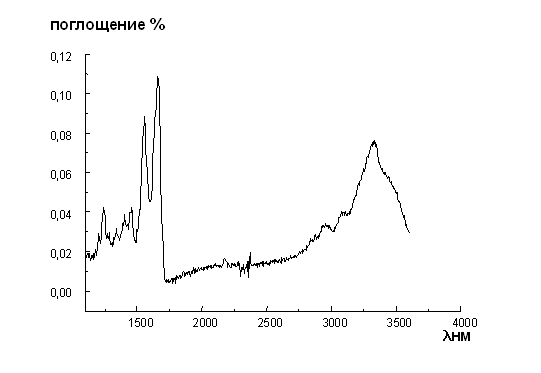
Физические подходы при исследовании молекулярных механизмов адаптации животных ( сусликов) при резком изменении температуры окружающей среды и их физиологического состояния (в условиях зимней спячки) Институт биофизики клетки РАН Научный руководитель: Лазарев Юрий Андреевич, д.ф.-м.н., проф. Адаптация животных к условиям, в которых жизнь считается практически невозможной является важным инструментом изучения возможностей высших организмов к переживанию различных стрессовых ситуаций и способов их преодоления. Одним из интереснейших моментов изучения адаптативных приспосабляемостей организма является изучение зимоспящих или “гибернирующих” животных, в частности, сусликов. При понижении температуры окружающей среды замедляется скорость метаболических процессов в организме животных и происходит одновременное понижение молекулярной динамики соединительной ткани. Изменение уровня молекулярной динамики может быть индуцировано разными причинами: частичной дегидратацией ткани; уменьшением степени ассоциации с углеводными компонентами соединительной ткани; изменением структурного состояния коллагена.Первым физическим методом, примененным для исследования структуры коллагенов, была рентгенография . В настоящее время для исследования структуры белка широко используются методы спектроскопии в ультрафиолетовой области, кругового дихроизма и инфракрасная спектроскопия, микрокалориметрические методы исследования термодинамических и структурных параметров.Как известно, методы спектроскопии являются чрезвычайно эффективными для исследований структуры биологических молекулярных соединений. Методами ИК- и УФ- спектроскопии можно точно определить качество выделения и очистки белков, выявить характерные структурные особенности. На рис.1 представлены ИК спектры коллагена шкуры спящего и проснувшегося сусликов. Как видно из рис.1 все полосы являются характеристическими и позволяют идентифицировать данный белок как эталонный без всяких примесей.
рис.1 ИК - спектры коллагена шкуры проснувшегося (слева)и спящего суслика(справа)
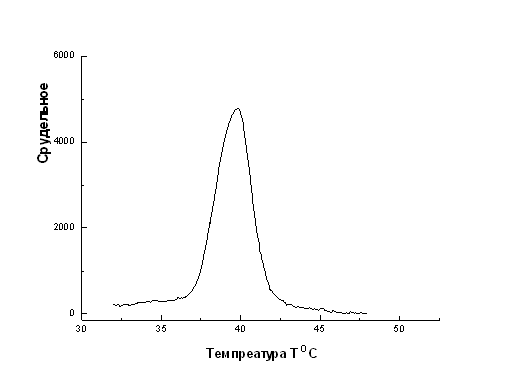
На рис.2 представлены термограммы коллагенов шкуры спящего и проснувшегося сусликов. Как видно из рисунков, кривые теплопоглощения в прогреваемых растворах коллагена имеют максимумы. Пик теплопоглощения совпадает с интервалом температур, в котором происходит резкое денатурационное изменение, представляет температуру денатурации. Из микрокалориметрических данных видно, что температуры денатурации образцов отличаются. Температура денатурации коллагена шкуры спящего суслика 39.9 0С, а проснувшегося суслика – 39.7 0С. Значение энтальпии коллагена шкуры спящего и проснувшегося суслика, получаемое как площадь под кривыми (рис.2), и подсчитанное с помощью программы ORIGIN29, равны соответственно: 19,3 кДж/Моль и 12,5 кДж/Моль.
Рис.2 Каллориметрическая запись теплопоглощения коллагена шкуры спящего суслика(слева) в растворе 0.05М СН 3СООН и 0.01М NaCl Концентрация белка в растворе Ссп =0.266 г/л и шкуры проснувшегося суслика(справа) в растворе 0.05М СН3СООН и 0.01М NaCl. Концентрация белка Спр= 0.2505 г/л
Проведенные экспериментальные данные показали, что очистка и выделение были проведены достаточно корректно, и мы имеем дело с индивидуальным белком и, примеси практически отсутствуют. Присутствие других белковых компонентов не превышает 1%, что непосредственно следует из данных ИК спектроскопии, поскольку полученный нами ИК спектр белка соответствует эталонному спектру .На основании полученных данных можно сделать следующие выводы:
|
| (c) АСФ России, 2001 |