ЭЛЕМЕНТНЫЙ ОБМЕН ЩЕЛОЧНЫХ МЕТАЛЛОВ В ГАЛЛАМНЫХ СИСТЕМАХ
Чумаков Денис Николаевич
Научный руководитель: Орлов Алексей Алексеевич, к.ф.-м.н., доцент, кафедра 23 ТПУ
Томский политехнический университет
, г.Томск, РоссияСовременные технологии требуют использования особо чистых материалов, причем требования к чистоте применяемых продуктов и технологии их получения усиливаются с каждым годом. Одной из наиболее сложных задач является получение чистых щелочных металлов (калия, натрия и др.). В настоящее время промышленное разделение щелочных элементов осуществляется высокоэффективным амальгамно-обменным методом.
Основным его недостатком является использование в больших количествах высокотоксичной ртути, что приводит к загрязнению окружающей среды усложнению средств и техники безопасности разделительного производства. В связи с этим приобретают актуальность работы направленные на создание высокоэффективных и экологически безопасных методов разделения щелочных металлов.Нами разрабатывается экологически безопасный галламно-обменный метод очистки и разделения щелочных металлов, в котором (вместо амальгамы) используется интерметаллическое соединение галлия с щелочным металлом - галлама.
Данная работа посвящена изучению обмена в системах
LiGa-NaOH, LiGa-KOH, KGa-NaOH. Задачей проводимых исследований являлось определение значений коэффициента разделения указанных пар щелочных металлов и кинетических параметров элементного обмена.Эксперименты показали, что равновесное состояние в системах
Li - Na, Li - K и K - Na наступает примерно через 15 минут.Коэффициент разделения a вычислялся для всех систем по результатам опытов, проведенных при различных начальных условиях.
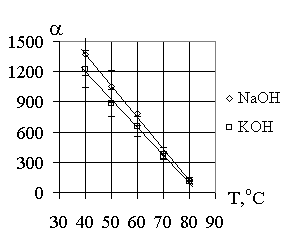
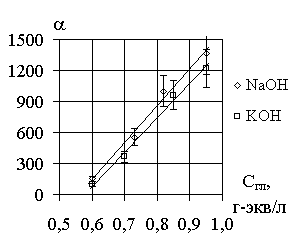
Установлено, что значения коэффициента разделения
Li и Na, Li и K в соответствующих галламно-обменных системах зависят от температуры, концентрации галламы и раствора. Влияние этих факторов показано на рис. 1-3.Для системы K - Na опыты проводились при следующих начальных
условиях: концентрации галламы калия 0,92 г-экв/л, концентрации водного раствора гидроксида лития 4,0 г-экв/л и температуре 40оС. Значение a при указанных условиях было равно 1,7.Полученные зависимости констант скорости обмена от температуры для систем
Li - Na, Li – K приведены на рис. 4. Графики (рис. 4) линейны, следовательно константы скорости реакций обмена и разложения описываются уравнением Аррениуса.Рис. 1. Зависимость коэффициента Рис. 2.
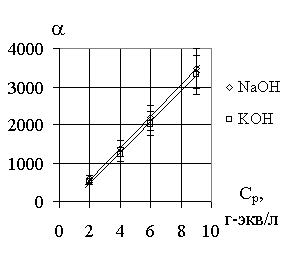
Зависимость коэффициента 

разделения от температуры. разделения от концентрации
С
LiGa = 0,95 г-экв/л, галламы лития. Т = 40оС,С
NaOH = 4,0 г-экв/л, СNaOH = 4,0 г-экв/л,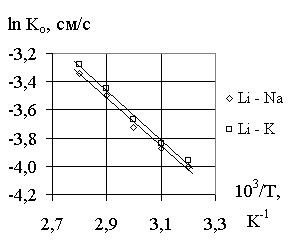
CKOH = 4,0 г-экв/л. CKOH = 4,0 г-экв/л.
Рис. 3. Зависимость коэффициента Рис. 4. Зависимость логарифма
разделения от концентрации константы скорости обмена
раствора. от обратной температуры.
СLiGa = 0,95 г-экв/л, Т = 40оС. СLiGa = 0,95 г-экв/л,
СNaOH = 4,0 г-экв/л,
СКOH = 4,0 г-экв/л.
Нами рассчитаны значения энергии активации реакций обмена. Для систем LiGa-NaOH и LiGa-KOH значения энергий активации соответственно равны Ео = 13,44 кДж/моль и Ео = 14,13 кДж/моль.
Для системы KGa-NaOH значение Ко = 1,51? 10-2 см/с при указанных выше условиях.
Высокие значения коэффициентов разделения в системах LiGa-NaOH и LiGa-KOH позволяют получить существенную очистку щелочных металлов друг от друга (95? 99%) уже при однократном проведении обмена.
e-mail: asf@asf.e-burg.ru