Даблешевич Алексей Анатольевич
Научный руководитель: Видяев Дмитрий Геннадьевич, к.ф.-м.н., ассистент кафедры 23 ТПУ
Томский политехнический университет
, г.Томск, РоссияПри разработке галламно-обменного метода разделения щелочных металлов, в котором в качестве обменной фазы вместо амальгамы используется интерметаллическое соединение галлия со щелочным металлом – галлама, проведены исследования по кинетике разложения галлам в однокомпонентных (
LiGa-LiOH, NaGa-NaOH, KGa-KOH) и двухкомпонентных (LiGa-NaOH, LiGa-KOH, KGa-NaOH) системах.Опыты проводились в интервале температур 40?
80оС при следующих концентрациях реагирующих фаз: галлама лития (натрия) – 0,95 г-экв/л, галлама калия – 0,92 г-экв/л, растворы гидроксидов лития, натрия и калия – 4,0 г-экв/л.Построенные по экспериментальным данным графики зависимости изменения концентрации галлам lnСГЛ в ходе опыта во всех случаях линейны, значит порядок реакции окисления лития (натрия, калия) первый.


По результатам опытов были определены кинетические характеристики разложения галлам: время полуразложения, плотность тока разложения и константа скорости разложения КР. Точность определения экспериментальных значений константы скорости разложения составила ± 15%. Графики зависимости константы скорости разложения галлам в одно- и двухкомпонентных системах от обратной температуры представлены на рис. 1 и 2.
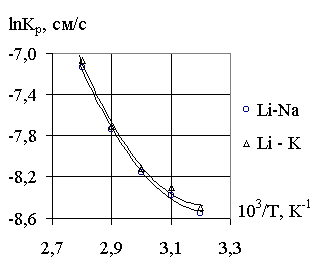
Рис. 1. Зависимость константы скорости разложения галлам лития, калия и натрия в водном растворе соответствующего гидроксида от обратной температуры. |
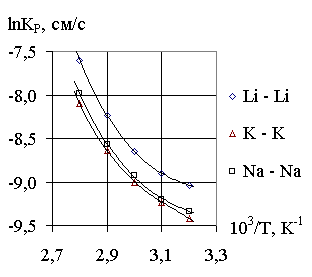
Рис. 2. Зависимость константы скорости разложения галламы лития в водных растворах гидроксида натрия и калия от обратной температуры. |
Видно (рис.1, 2), что с ростом температуры скорость разложения галлам увеличивается, поэтому процесс обмена в данных системах целесообразно проводить при температуре 40оС.
Анализ полученных данных по кинетике разложения показал, что скорость разложения галламы увеличивается в ряду натрий < калий < литий.
Установлено, что скорость разложения двухкомпонентных галлам выше, чем скорость разложения однокомпонентных галлам.
На основе экспериментальных данных выведена полуэмпирическая формула, описывающая процесс разложения галлам в исследованных системах.
В общем виде выражение для скорости разложения галламы было представлено в следующем виде:
W = -dCГЛ/dt = -КСГЛ = КС’ГЛe -Kt,
причем К= (К
1 + К2)/СОН-,где К – константа скорости разложения, с
-1, СГЛ и С’ГЛ – соответственно текущая и начальная концентрации галламы, г-экв/л, t – время, с, К1 и К2 – две составляющие константы скорости реакции разложения.При этом считали, что скоростью обратной реакции можно пренебречь. Значения К
1 и К2 находили как предел зависимости lnКР – 103/Т, имеющей перегиб. Для низких температур считали, что К1 > К2, а для высоких К2 > К1.Выражения для К
1 и К2 записаны следующим образом:К
1 = К01е -96500/(RT) , К2 = К02е -10000/(RT)где Т – температура, К,
R – газовая постоянная, Дж моль-1 К-1.Для К
01 и К02 в изученных системах получили следующие выражения:1) LiGa – LiOH – К01 = 0,732е32,5 , К02 = 0,32СОН-/ (1+СОН-) е3,37
2) NaGa – NaOH – К01 = 0,725е31,2 , К02 = 0,317СОН-/ (1+СОН-) е2,1,
3) KGa – KOH – К01 = 0,677е31,4, К02 = 0,31СОН-/ (1+СОН-) е2,2,
4) LiGa – NaOH – К01 = 0,655е32,3 , К02 = 0,278СОН-/ (1+СОН-) е3,1,
5) LiGa – KOH – К01 = 0,708е32,3 , К02 = 0,291СОН-/ (1+СОН-) е3,1.
Показано, что разница расчетных и экспериментальных значений КР мала.
Сравнение кинетических параметров разложения галлам и амальгам соответствующих щелочных металлов показывает, что скорость разложения галлам примерно в 2 раза выше скорости разложения соответствующих амальгам щелочных металлов той же концентрации. По нашему мнению это можно объяснить более низким перенапряжением водорода на галлии. Выделение водорода является наиболее медленной стадией, и поэтому определяет скорость протекания всего процесса разложения.
e-mail: asf@asf.e-burg.ru